Попередня сторінка: 5. Az ionos kötés. Ionos vegyületek
Наступна сторінка: 7. A hidrogénkötés. A fémes kötés
E téma tananyaga segít nektek:
összefoglalni a kovalens kötésről és jellemzőiről kapott ismereteket;
ismereteket szerezni a kovalens kötés kialakulásának mechanizmusáról;
megmagyarázni a molekuláris és az atomrácsszerkezetű anyagok közötti különbséget.
A kovalens kötés. Már tudjátok, hogy a kovalens kötés közös elektronpár képződése eredményeként jön létre az atomok párosítatlan elektronjai révén. Két atom ütközése során a párosítatlan elektront tartalmazó atompályák fokozatosan átfedik egymást, és egy olyan kapcsolat alakul ki, amelyben a két atommagot közös elektronfelhő veszi körül. így keletkeznek a közös elektronpárok.
Kovalens kötéssel összekapcsolt atomok megtalálhatók úgy a molekulákban, mint az összetett ionokban is
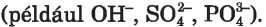
A kovalens kötés jellemzői. A kovalens kötés égjük osztályozása a közös elektronpárok száma szerint történik. A hidrogénmolekulában vagy a halogének molekuláiban az atomok között egyszeres kovalens kötés van, az oxigén-
molekulában kétszeres, a nitrogén molekulájában háromszoros kovalens kötés jön létre:

Ha közös elektronpár alakul ki az atomok között, akkor egyszeres kovalens kötés jön létre:

Érdekes
tudnivaló
Az egyszeres kötést egyszerű kötésnek is nevezik.
Kétszeres kovalens kötés két közös elektronpár, háromszoros kovalens kötés három közös elektronpár képződésével jön létre. Részletesen erről a szerves kémia tananyagában tanultatok a szénhidrogének témakörben az étén (C2H4 vagy

és az étin
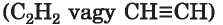
példáján. A többszörös kovalens kötések egyik összetevője a tengelyszimmetrikus o-kötés, amelynél az elektronpályák részleges átfedése az atommagon átmenő képzeletbeli egyenes mentén jön létre. A másik összetevő (a hármas kötésnél kettő van belőle) a síkszimmetrikus я-kötés, melyben az elektronfelhő részleges átfedése az atommagon átmenő képzeletbeli egyenes mindkét oldalán történik:

Az oxigén és a nitrogén molekuláiban milyen atompályák és hogyan fedik át egymást?
A C6H6 képletű benzol molekulájában és néhány más szerves vegyületben a gyűrűt alkotó szénatomok között különleges kovalens kötés alakul ki. Ennek a kötésnek egyik összetevője egy közös я-elektronszextett:
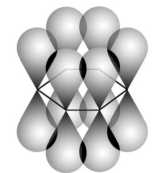
Ezt a szerkezetet egyszerűen egy szabályos hatszögbe írt körrel szokás ábrázolni:
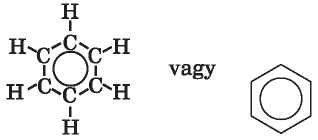
A kovalens kötés fontos jellemzője a polaritása. A közös elektronpár eltolódhat az elek-tronegatívabb atom felé. Ekkor az atomnál részlegesen negatív töltés (S-), míg a másik atomnál azonos nagyságú részlegesen pozitív töltés (S+) alakul ki: például a
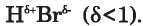
Ez a kötés
kovalens poláris:
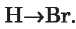
Két azonos atom (vagy azonos elektronegativitású atom) kapcsolódása esetén a kötő elektronpár azonos mértékben tartozik mindkét atomhoz. így ez a kovalens kötés apoláris (nem poláris).
Érdekes
tudnivaló
A részleges töltések a HBr-molekulában +0,12 (H) és-0,12 (Br).
Osztályozzátok a felsorolt képleteket kovalens kötésük polaritása szerint: Br2, H2O, SCl4, PH3, Cl2Ov.
A kovalens erős elsőrendű kötés, felszakításához jelentős energiaráfordítás szükséges. így a klórmolekula Cl-Cl 1000 ”C-nál, a nitrogénmolekula
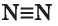
3000 °C-nál bomlik atomjaira.
A többszörös kovalens kötések egyik összetevője, a o-kötés energetikailag stabilabb, mint a többi. Ezt az étén és az étin tulajdonságainak tanulásánál ismerhettétek fel. A telítetlen szénhidrogének addí-cionálják a hidrogént, a halogéneket, a hidrogén-halogenideket és telítettekké válnak. Eközben a szénatomok között a gyengébb н-kötés hasad fel, és egyszeres kovalens kötéssé alakul:
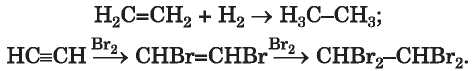
A kovalens kötés kialakulásának mechanizmusa. A paragrafusban eddig tárgyalt kovalens kötés mechanizmusa azzal kapcsolatos, hogy az atom stabil elektronszerkezetének kialakításához mindkét atom bead a közösbe egy (vagy több) elektront, így közös elektronpár alakul ki. Ilyen mechanizmussal alakulnak ki az elemmolekulák (oxigén, nitrogén stb.) és a vegyület-molekulák többsége: a víz, a kénhidrogén, az ammónia és mások. így az ammóniamolekulában (NH3) a nitrogénatom párosítatlan 2p-elektronjai

a hidrogénatomok párosítatlan ls-elektronjával együtt három közös elektronpárt alkotnak (egyszeres kovalens kötéssel):
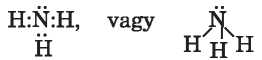
Előfordulhat azonban, hogy a kötő elektronpár mindkét elektronját egy atom adja. Vizsgáljuk meg az ammónium-ion NH4 keletkezésénél kialakuló kötésnél:
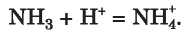
A két részecske összekapcsolása az ammónia- és a hidrogén-kationokat tartalmazó savoldat1 (a sav elektroli-tikus disszociációja miatt) kölcsönhatása során keleti kezik. Az ammóniamolekula és a H+-ion találkozásánál a nitrogénatom nem kötő 2s-elektronpárja átmegy
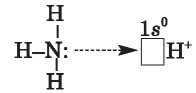
a hidrogén-ion üres ls-atampályájáraés közössé válik mindkét részecske számára A kovalens kötés donor-akceptor mechanizmus szerint képződik. A kötő elektronpárt a nitrogén adja - ő a donor, a hidrogén-kation -az akceptor1:

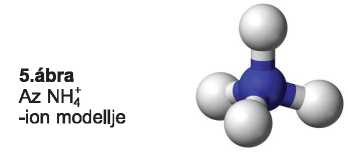
így tehát az NH^ ammómum-ionban négy egyszeres kovalens kötés van. Ezek azonos értékűek, holott keletkezésük mechanizmusa eltérő. A nitrogén ebben az ionban IV vegyértékű (ez a lehetséges maximális vegyérték számára), oxidációs száma viszont -3. Az ammónium-ion, akár a metánmolekula, tetraéderes szerkezettel rendelkezik (5. ábra).
A 10. osztályban tanultátok, hogy az aminok reagálnak a savakkal. Magyarázzátok meg a metilammónium-ion (CH3NH3) keletkezésének mechanizmusát a metilamin (CH3NH2) és a hidrogénion (H+) egyesülésével.
A hidrogén-kationnal a vízmolekula is egyesülhet Ez a folyamat is donor-akceptor mechanizmussal megy végbe. A vízmolekulában két egyszeres kovalens kötés van az oxigén- és a hidrogénatomok között, a harmadik kötés elektronpárja az oxigénatomtól származik, a ht-ion az üres 1s-atompályát adja. Az ilyen kölcsönhatás eredménye az oxónium-ion
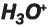
(6. ábra):
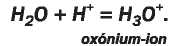
Ezek az ionok a savak vizes oldataiban találhatók, valamint elenyésző mennyiségben a vízben is.

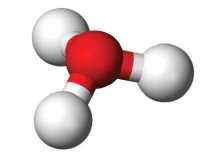
6. ábra
A H3O+-ion modellje
Az anyagok molekuláris és atomrácsos szerkezete. Kovalens kötés található az elemmolekulákban, a nemfémes oxidokban, a savakban, a nemfémek hidrogénvegyületeiben, a szerves vegyületekben: szénhidrogénekben, alkoholokban, aldehidekben, aminokban, fehérjékben stb. (7. ábra).

7. ábra
Molekuláris
szerkezetű
anyagok
Sok molekuláris szerkezetű vegyületnek van szaga (így a vanűlinnak, az ecet savnak, az ammóniának, a kénhidrogénnek, a benzolnak), olvadás- és forráspontjuk alacsony. Ez azzal magyarázható, hogy a molekulákat gyenge, másodlagos kötőerők tartják össze.
Létezik néhány egyszerű és összetett anyag, melyek szerkezete atomrácsos. Az atomrácsos kristályok rácspontjaiban atomok helyezkednek el, melyeket kovalens kötés kapcsol össze. Az anyag kristálydarabkáját egy gigantikus molekulához hasonlíthatjuk. Буеп szerkezettel rendelkezik többek között a grafit, a gyémánt, a vörös foszfor, a szilícium(IV)-oxid (8. ábra).
Az atomrácsos kristályok sem vízben, sem szerves oldószerben nem oldódnak; az erős kovalens kötések következtében kemények és olvadáspontjuk magas. Magas keménységével tűnik ki a gyémánt, a szüídum-karbid (SiC), a bór-nitrid (BN).

8. ábra
Atomrácsos
szerkezetű
anyagok
ÖSSZEFOGLALÁS
Kovalens kötést az atomok között közös elektronpárok hoznak létre, hogy mindegyik atom stabilis elektronszerkezettel rendelkezhessen. A kötés kialakulásának mechanizmusa lehet megosztó, amikor mindegyik atom bead 1-1 elektront, és donor-akceptor, amikor egy atom bead egy egész elektronpárt, a másik részecske a szabad atompályát biztosítja.
A kovalens kötés erős elsőrendű kötés. Ilyen kötés található a molekuláris és az atomrácsos szerkezetű anyagokban, valamint az összetett ionokban.
A kötésben részt vevő elektronpárok számától függően lehetséges egyszeres vagy többszörös (kétszeres, háromszoros stb.) kovalens kötés; polaritás szerint lehet poláris és apoláris.
A molekuláris szerkezetű és az atomrácsos anyagok fizikai tul^jdonságaikban alapvetően különböznek egymástóL
47. A felsorolt vegyületek közül melyikben található kovalens kötés: MgI2, CH4, SO2, SiCl4, Na2S.
48. Jellemezzétek a hidrogén-kloridban található kémiai kötést. Ábrázoljátok az atompályák átfedődését, határozzátok meg a kötésben részt vevő elektronok számát, a hidrogén és a klór közötti kötés polaritását. A feleletet indokoljátok.
49. Az alábbi képletű anyagok közül - Cl2O és NH3 - melyekben található poláris kovalens kötés, határozzátok meg az elektronegatí-vabb elemet és jelezzétek az atomon található részleges töltést (használva a 8 jelölést).
50. Rajzoljátok fel a hidrogén-peroxid (H202)-molekula szerkezeti képletét. A molekulában melyik kötés apoláris? Határozzátok meg a molekulát alkotó mindegyik elem vegyértékét és oxidációs számát.
51. Hasonlítsátok össze a megosztó és a donor-akceptor mechanizmus szerint kialakuló kovalens kötést. Magyarázzátok meg a mechanizmusok elnevezését.
52. A BF3 molekula az F—ionnal egyesülve kovalens kötést alkot a donor-akceptor mechanizmus szerint. írjátok fel a keletkező ion képletét. Melyik részecske az elektronpár donorja és melyik az akceptor? Milyen atompályát biztosít az akceptor az elektronpár számára? Vegyétek figyelembe, hogy a bór a molekulájában és az összetett ionokban gerjesztett állapotban található.
53. A felsorolt anyagok közül melyiknek molekuláris a szerkezete: propán, égetett mész, metanol, kénhidrogén, ezüst? Milyen ismertetőjelek utalnak erre?
54. Mivel magyarázható a szén(IV)-oxid és a szilícium(IV)-oxid fizikai tulajdonságainak eltérése, holott mindkét oxidban azonos kémiai kötés található.
55. A bór, mint egyszerű anyag, 2075 °C-nál olvad és nagyon kemény anyag. Molekuláris vagy atomrácsos szerkezete van?
Ez a tankönyv anyaga Kémia a 11. osztály számára Pavlo Popéi
Наступна сторінка: 7. A hidrogénkötés. A fémes kötés